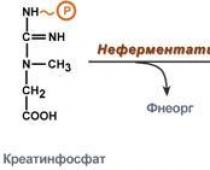
Креатинфосфорная кислота (креатинфосфат , фосфокреатин) - 2-[метил-(N"-фосфонокарбоимидоил)амино]уксусная кислота. Бесцветные кристаллы, растворимые в воде, легко гидролизуется с расщеплением фосфамидной связи N-P в кислой среде, устойчива в щелочной.
Кислота была открыта Филиппом и Грейс Эгглтонами из Кембриджского университета и независимо Сайрусом Фиске и Йеллапрагадой Суббарао из Гарвардской медицинской школы в 1927 году.
Лабораторный синтез - фосфорилирование креатина POCl 3 в щелочной среде.
Креатинфосфат - продукт обратимого метаболического N-фосфорилирования креатина , являющийся, подобно АТФ , высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатинфосфат гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина G 0 ~ −43 кДж/моль, в то время как при гидролизе АТФ до АДФ G 0 ~ −30.5 кДж/моль.
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
креатинфосфат + АДФ ⇔ креатин + АТФЭта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается вправо, что ведёт к восстановлению нормальной концентрации АТФ.
Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается.
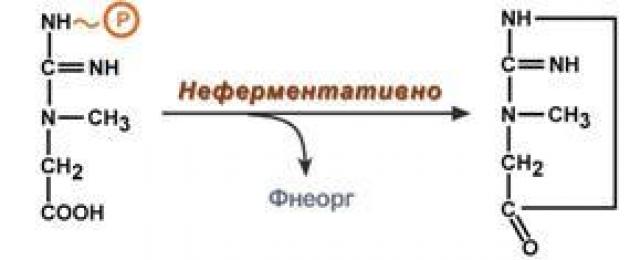
В тканях креатинфосфат подвергается самопроизвольному неферментативному гидролизу с циклизацией в креатинин , выводящийся с мочой , уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком.
Креатинфосфат является одним из фосфагенов - N-фосфорилированных производных гуанидина , являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих беспозвоночных (например, насекомых) роль фосфагена играет аргининфосфорная кислота , у некоторых кольчатых червей - N-фосфоломбрицин.
Креатин – вещество скелетных мышц, миокарда, нервной ткани. В виде креатинфосфата креатин является "депо" макроэргических связей, используется для быстрого ресинтеза АТФ во время работы клетки.
Использование креатинфосфата для ресинтеза атф
Особенно показательна роль креатина в мышечной ткани. Креатинфосфат обеспечивает ресинтез АТФ в первые секунды работы (5‑10 сек), когда ни анаэробный гликолиз, ни аэробное окисление глюкозы и жирных кислот еще не активировано, и кровоснабжение мышцы не увеличено. В клетках нервной ткани креатинфосфат поддерживает жизнеспособность клеток при отсутствии кислорода.
При мышечной работе ионы Са 2+ , высвободившиеся из саркоплазматического ретикулума, являютсяактиваторами креатинкиназы. Реакция еще интересна тем, что на ее примере можно наблюдать обратную положительную связь - активацию фермента продуктом реакции креатином . Это позволяет избежать снижения скорости реакции по ходу работы, которое должно было бы произойти по закону действующих масс из-за снижения концентрации креатинфосфата в работающих мышцах.
Около 3% креатинфосфата постоянно в реакции неферментативного дефосфорилирования превращается вкреатинин . Количество креатинина, выделяемое здоровым человеком в сутки, всегда почти одинаково и зависит только от объема мышечной массы.

Образование креатинина из креатинфосфата
Синтез креатина идет последовательно в почках и печени в двух трансферазных реакциях. По окончании синтеза креатин с током крови доставляется в мышцы или мозг.


Реакции синтеза креатина в почках и печени
Здесь при наличии энергии АТФ (во время покоя или отдыха) он фосфорилируется с образованием креатинфосфата.
Синтез креатинфосфата
Если синтез креатина опережает возможности его фиксации в мышечной ткани, то развивается креатинурия – появление креатина в моче. Физиологическая креатинурия наблюдается в первые годы жизни ребенка. Иногда к физиологической относят и креатинурию стариков, которая возникает как следствие атрофии мышц и неполного использования образующегося в печени креатина. При заболеваниях мышечной системы (при миопатии или прогрессирующей мышечной дистрофии) в моче наблюдаются наибольшие концентрации креатина – патологическая креатинурия.
В мышце дезаминирование аминокислот идет особым образом
Так как в скелетных мышцах нет глутаматдегидрогеназы и нет возможности производить прямое дезаминирование аминокислот, то для этого существует особый путь.
В мышечных клетках при интенсивной работе, когда идет распад мышечных белков, активируетсяальтернативный способ дезаминирования аминокислот – цикл АМФ-ИМФ . Образовавшийся при трансаминировании глутамат при участии аспартатаминотрансферазы реагирует с оксалоацетатом и образуется аспарагиновая кислота. Аспартат далее передает свою аминогруппу на инозинмонофосфат (ИМФ) с образованием АМФ, который в свою очередь подвергается дезаминированию с образованием свободного аммиака.

Реакции непрямого дезаминирования аминокислот в мышечной ткани
Процесс носит защитный характер , т.к. при мышечной работе выделяется молочная кислота. Аммиак, связывая ионы Н + , предотвращает закисление цитозоля миоцитов.
Креатинфосфат
Креатинфосфорная кислота (креатинфосфат , фосфокреатин) - 2-[метил-(N"-фосфонокарбоимидоил)амино]уксусная кислота. Бесцветные кристаллы, растворимые в воде, легко гидролизуется с расщеплением фосфамидной связи N-P в кислой среде, устойчива в щелочной.
Лабораторный синтез - фосфорилирование креатина POCl 3 в щелочной среде.
Креатинфосфат - продукт обратимого метаболического N-фосфорилирования креатина , являющийся, подобно АТФ , высокоэнергетическим соединением. Однако, в отличие от АТФ, гидролизуемой по пирофосфатной связи O-P, креатин гидролизуется по фосфамидной связи N-P, что обуславливает значительно больший энергетический эффект реакции. Так, при гидролизе изменение свободной энергии для креатина ~ -43 кДж/моль, в то время как при гидролизе АТФ до АДФ ~ -30 кДж/моль.
Креатинфосфат содержится преимущественно в возбудимых тканях (мышечная и нервная ткани) и его биологической функцией является поддержание постоянной концентрации АТФ за счёт обратимой реакции перефосфорилирования:
креатинфосфат + АДФ ⇔ креатин + АТФЭта реакция катализируется цитоплазматическими и митохондриальными ферментами-креатинкиназами; при расходе (и, соответственно, падении концентрации) АТФ, например, при сокращении клеток мышечной ткани, равновесие реакции сдвигается в вправо, что ведёт к восстанавлению нормальной концентрации АТФ.
Концентрация креатинфосфата в покоящейся мышечной ткани в 3-8 раз превышает концентрацию АТФ, что позволяет компенсировать расход АТФ во время кратких периодов мышечной активности, в период покоя при отсутствии мышечной активности в ткани идёт гликолиз и окислительное фосфорилирование АДФ в АТФ, в результате чего равновесие реакции смещается влево и концентрация креатинфосфата восстанавливается.
В тканях креатинфосфат подвергается самопроизвольноми неферментативному гидролизу с циклизацией в креатинин , выводящийся с мочой , уровень выделения креатинина зависит от состояния организма, меняясь при патологических состояниях, и является диагностическим признаком.
Креатинфосфат является одним из фосфагенов - N-фосфорилированных производных гуанидина , являющихся энергетическим депо, обеспечивающим быстрый синтез АТФ. Так, у многих беспозвоночных (например, насекомых) роль фосфагена играет аргининфосфорная кислота, у некоторых кольчатых червей - N-фосфоломбрицин.
См. также
При сокращении клеток мышечной ткани, равновесие реакции сдвигается вправо, что ведёт к восстановлению нормальной концентрации АТФ.
В тканях креатинфосфат подвергается самопроизвольному неферментативному гидролизу с циклизацией в креатинин, ...
Литература
- Креатинфосфорная кислота (формула). Большая советская энциклопедия
Wikimedia Foundation . 2010 .
Синонимы :Смотреть что такое "Креатинфосфат" в других словарях:
Креатинфосфат … Орфографический словарь-справочник
Сущ., кол во синонимов: 1 неотон (5) Словарь синонимов ASIS. В.Н. Тришин. 2013 … Словарь синонимов
- (син.: креатинфосфорная кислота, фосфокреатин) макроэргическое фосфорное производное креатина, способное вступать в обменную реакцию переноса остатка фосфорной кислоты с АДФ; участвует в энергетическом обмене … Большой медицинский словарь
Креатинфосфат обладает способностью отсоединять фосфатную группу и превращаться в креатин, присоединяя фосфатную группу к АДФ, которая превращается в АТФ.
АДФ + креатинфосфат = АТФ + креатин
Эта реакция получила название - реакции Ломана. Запасы креатинфосфата в волокне не велики, поэтому он используется в качестве источника энергии только на начальном этапе работы мышцы - в первые несколько секунд.
После того, как запасы креатинфосфата будут исчерпаны примерно на 1/3, скорость этой реакции будет снижаться, а это вызовет включение других процессов ресинтеза АТФ - гликолиза и кислородного окисления. По окончании работы мышцы реакция Ломана идет в обратном направлении, и запасы креатинфосфата в течение нескольких минут восстанавливаются.
Расщепление креатинфосфата играет основную роль в энергообеспечении кратковременных упражнений максимальной мощности - бег на короткие дистанции, прыжки, метание, тяжелоатлетические и силовые упражнения, продолжительностью до 20-30сек.
Гликолиз.
Гликолиз - процесс распада одной молекулы глюкозы (C6H12O6) на две молекулы молочной кислоты (C3H6O3) с выделением энергии, достаточной для "зарядки" двух молекул АТФ.
C6H12O6(глюкоза) + 2H3PO4 + 2АДФ = 2C3H6O3 (молочная к-та) + 2АТФ + 2H2O.
Гликолиз протекает без потребления кислорода (такие процессы называются анаэробными).
Но нужно сделать два важных замечания:
а) примерно половина всей выделяемой в данном процессе энергии превращается в тепло и не может использоваться при работе мышц. При этом температура мышц повышается до 41-42 градусов Цельсия,
б) энергетический эффект гликолиза не велик и составляет всего 2 молекулы АТФ из 1 молекулы глюкозы.
Гликолиз играет важную роль в энергообеспечении упражнений, продолжительность которых составляет от 30 сек до 150сек. К ним относятся бег на средние дистанции, плавание 100-200м, велосипедные гонки, длительные ускорения.
Кислородное окисление.
Для полноценного включения в действие кислородного окисления глюкозы требуется больше времени. Скорость окисления становится максимальной лишь через 1,5-2 минуты работы мышц, этот эффект широко известен под названием "второе дыхание".
Распад глюкозы в присутствии кислорода идет сложным путем. Это многостадийный процесс, включающий в себя цикл Кребса и многие другие превращения, но суммарный результат может быть выражен следующей записью:
C6H12O6(глюкоза) + 6O2 + 38АДФ + 38H3PO4 = 6CO2 + 44H2О + 38АТФ
Т.е. распад глюкозы по кислородному (аэробному) пути дает в итоге с каждой молекулы глюкозы 38 молекул АТФ. То есть кислородное окисление энергетически в 19 раз эффективнее безкислородного гликолиза. Но за все надо платить - в данном случае платой за большую эффективность является затянутость процесса. Получение молекул АТФ при кислородном окислении возможно только в митохондриях, а там АТФ недоступна АТФазам, которые находятся во внутриклеточной жидкости - внутренняя мембрана митохондрий непроницаема для заряженных нуклеотидов. Поэтому АТФ из митохондрий доставляется во внеклеточную жидкость достаточно сложным путем, используя при этом различные ферменты, что в целом существенно замедляет процесс получения энергии.
Для полноты картины упомяну еще и о последнем пути ресинтеза АТФ - миокиназная реакция . В случае значительного утомления, когда возможности других путей получения уже исчерпаны, и в мышцах накопилось много АДФ, то из 2 молекул АДФ при помощи фермента миокиназа возможно получение 1 молекулы АТФ:
АДФ + АДФ = АТФ + АМФ.
Но эту реакцию можно рассматривать как "аварийный" механизм, который не очень эффективен и поэтому организм очень редко к нему прибегает и только в крайнем случае.
Итак, существует несколько способов получения молекул АТФ. Далее АТФ при помощи катионов кальция и АТФазы "заряжает" миозин энергией, которая используется для спайки с актином и для продвижения актиновой нити на один "шаг".
И здесь есть одна важная особенность.
Миозин может иметь различную (большую или меньшую) активность АТФазы, поэтому в целом выделяют различные типы миозина - быстрый миозин характеризуется высокой активностью АТФазы, медленный миозин характеризуется меньшей активностью АТФазы.
Собственно, поэтому и скорость сокращения мышечного волокна определяются типом миозина. Волокна, с высокой активностью АТФазы принято называть быстрыми волокнами, волокна, характеризующиеся низкой активностью АТФазы, - медленными волокнами.
Быстрые волокна требуют высокой скорости воспроизводства АТФ, обеспечить которую может только гликолиз, так как, в отличие от окисления, он не требует времени на доставку кислорода к митохондриям и доставку энергии от них во внутриклеточную жидкость.
Поэтому быстрые волокна (их еще называют белыми волокнами) предпочитают гликолитический путь воспроизводства АТФ. За высокую скорость получения энергии белые волокна платят быстрой утомляемостью, так как гликолиз, ведет к образованию молочной кислоты, накопление которой вызывает усталость мышцы и в конечном итоге останавливает ее работу.
Медленные волокна не требуют столь быстрого восполнения запасов АТФ и для обеспечения потребности в энергии используют путь окисления. Медленные волокна еще называют красными волокнами. Эти волокна окружены массой капилляров, которые необходимы для доставки с кровью большого количества кислорода. Энергию красные волокна получают путем окисления в митохондриях углеводов и жирных кислот. Медленные волокна являются низко утомляемыми и способны поддерживать относительно небольшое, но длительное напряжение.
Итак, мы вкратце ознакомились с устройством и энергетическим обеспечением мышц, но нам осталось выяснить что же с мышцами происходит во время тренировки.
Микроскопические исследования показывают, что в результате тренировок в ряде мышечных волокон нарушается упорядоченное расположение миофибрилл, наблюдается распад митохондрий, а в крови повышается уровень лейкоцитов, как при травмах или инфекционном воспалении (Морозов В.И., Штерлинг М.Д с соавторами).
Разрушение внутренней структуры мышечного волокна во время тренировки (т.е. микротравмы), приводит к появлению в волокне обрывков белковых молекул. Иммунная система воспринимает обрывки белка как чужеродный белок, тут же активизируется и старается их уничтожить.
Итак, на тренировках мы разрушаем свои мышечные волокна и тратим запасы АТФ.
Но мы ходим в тренажерный зал вовсе не для того, чтобы израсходовать энергию и получить микротравмы. Мы ходим, чтобы накачать мышцы и стать сильнее.
Это становится возможным только благодаря такому явлению, как суперкомпенсация (сверхвосстановление). Суперкомпенсация проявляется в том, что в строго определенный момент отдыха после тренировки уровень энергетических и пластических веществ превышает исходный дорабочий уровень.
Закон суперкомпенсации справедлив для всех биологических соединений и структур, которые в той или иной мере расходуются при мышечной деятельности. К ним относятся: креатинфосфат, структурные и ферментные белки, фосфолипиды, клеточные органеллы (митохондрии, лизосомы).
В целом, явление суперкомпенсации может быть отражено графиком (рис.3).
Рис.3. Суперкомпенсация. а) - разрушение /расходование во время тренировки, б) - восстановление, в) - сверхвосстановление, г) - возвращение к исходному уровню.
Как становится ясно из график, фаза суперкомпенсации длится достаточно короткое время. Постепенно уровень энергетических веществ возвращается к норме и тренировочный эффект исчезает.
Больше того, если проводить следующую тренировку до наступления фазы суперкомпенсации (рис.4, а), то это приведет только к истощению и перетренированности.
Если проводить следующую тренировку после фазы суперкомпенсации (рис.4, б), то следы предыдущей работы уже сгладятся и тренировка не принесет ожидаемого результата - увеличения мышечной массы и силы.
Чтобы добиться выраженного эффекта, нужно проводить тренировку строго в фазе суперкомпенсации (рис.4, в).

Рис. 4. Тренировочный эффект (черным выделены моменты тренировок). а) - слишком частые тренировки, истощение и перетренированность, б) - слишком редкие тренировки, никакого существенного эффекта, в) - правильный тренировки в момент суперкомпенсации, рост силы и мышечной массы.
Итак, из вышеизложенного ясно, что проводить тренировки надо в фазе суперкомпенсации.
Но тут мы встречаемся с одной сложной проблемой.
Дело в том, что соединения и структуры, которые расходуются или разрушаются при тренировке, имеют разное время восстановления и достижения суперкомпенсации!
Фаза суперкомпенсации креатинфосфата достигается через несколько минут отдыха после нагрузки.
Фаза суперкомпенсации содержания гликогена в мышцах наступает через 2-3 суток после тренировки, а к этому моменту уровень креатинфосфата уже вступит в фазу утраченной суперкомпенсации.
А вот для восстановления белковых структур клеток, разрушенных в ходе тренировок, может потребоваться еще больший период времени (до 7-12 дней), в течение которого уровень гликогена в мышцах уже вернется к исходному уровню.
Поэтому нужно в первую очередь определиться какой из этих параметров наиболее важен с точки зрения наращивания силы и мышечной массы, а каким из них можно и пренебречь.
Очевидно, что первым параметром, на который нужно ориентироваться в ходе тренировок является уровень креатинфосфата - ведь именно им обеспечивается силовая работа мышц.
Среди высокоэнергетических фосфорилированных соединений имеется одно, играющее особую роль в энергетике возбудимых тканей, таких, как мышечная и нервная. Это соединение, креатинфосфат, или фосфокреатин (рис. 14-13), служит резервуаром высокоэнергетических фосфатных групп. гидролиза креатинфосфата несколько превышает гидролиза АТР.
Креатинфосфат может передавать свою фосфатную группу на ADP в реакции, катализируемой креатинкиназой:
Благодаря креатинфосфату концентрация АТР в мышечных клетках поддерживается на постоянном и притом довольно высоком уровне. Особенно это существенно для скелетных мышц, работающих с перерывами, но иногда очень напряженно с большой скоростью. Всякий раз, когда часть АТР мышечной клетки расходуется на сокращение, в результате гидролиза АТР образуется ADP. Креатинфосфат при участии креатинкиназы быстро передает свою фосфатную группу молекулам ADP, и нормальный уровень АТР восстанавливается. Содержание креатинфосфата в мышцах в 3-4 раза превышает содержание АТР (табл. 14-4); поэтому в форме креатинфосфата может храниться достаточное количество фосфатных групп, полностью обеспечивающее поддержание постоянного уровня АТР в короткие периоды усиленной мышечной активности.

Рис. 14-12. В ресничках и жгутиках эукариотических клеток механическая сила развивается за счет использования АТР. А. Поперечный разрез реснички. Эти структуры состоят из девяти пар микротрубочек, образующих наружное кольцо, и двух одиночных центральных микротрубочек (расположение по типу «9 + 2»; разд. 2.16). Реснички окружены оболочкой, представляющей собой вырост клеточной мембраны. Энергию для характерных движений ресничек (волнообразного, скользящего или вращательного) поставляет гидролиз АТР. Эти движения осуществляются ресничками за счет скольжения или скручнвання парных микротрубочек, которое весьма напоминает наблюдаемое в скелетных мышцах АТР-зависимое скольжение толстых и тонких нитей друг относительно друга. От наружных (парных) микротрубочек отходят находящиеся на равном расстоянии друг от друга отростки, или выступы, напоминающие миозиновые головки в толстых нитях мышц. Эти выступы состоят из молекул динеина - довольно крупного белка, обладающего АТРазной активностью. Катализируемый динеином гилролиз АТР поставляет энергию для механического движения - скольжения или скручивания микротрубочек. Было высказано предположение, что центральные микротрубочки регулируют скорость движения ресничек. Б. Отдельные фазы биения реснички в жабрах морского червя, у которого реснички имеют длину около 30 мкм. Эти характерные движения сообщает ресничкам АТР-зависимое скольжение трубчатых нитей друг относительно друга.

Рис. 14-13. Креатинфосфат в мышцах играет роль запасного донора высокоэнергетических фосфатных групп. Он действует как своеобразный буфер, обеспечивающий постоянство концентрации АТР.
Благодаря обратимости креатинкиназной реакции накопившийся креатин в период восстановления вновь фосфорилируется за счет АТР до креатинфосфата. Поскольку другого метаболического пути для образования и расщепления креатинфосфата не существует, это соединение хорошо приспособлено для выполнения своей функции - резервуара фосфатных групп.
В мышцах многих беспозвоночных роль носителя резервной формы энергии выполняет не креатинфосфат, а аргипипфосфат. Соединения, служащие, подобно креатинфосфату и аргининфосфату, запасными источниками энергии, носят название фосфагенов.
14.16. АТР поставляет энергию также и для активного транспорта через мембраны
Химическая энергия АТР используется также и для выполнения осмотической работы, т.е. работы, необходимой для переноса каких-либо ионов или молекул через мембрану из одного компартмента в другой, в котором их концентрация выше. Мы можем рассчитать количество свободной энергии, необходимое для переноса 1 моль неионизованного растворенного вещества через мембрану, например из окружающей среды в клетку, если нам известны концентрации растворенного вещества в несвязанной форме в окружающей среде и в клетке (рис. 14-14). Для такого расчета воспользуемся общим уравнением

где - молярная концентрация данного растворенного вещества в окружающей среде, - его молярная концентрация в клетке, R - газовая постоянная и Т - абсолютная температура. Пользуясь этим уравнением, можно определить количество свободной энергии, необходимое для того, чтобы переместить 1 моль глюкозы против стократного градиента концентрации, например из среды с исходной концентрацией глюкозы в компартмент, где ее конечная концентрация составит . Подставляя в уравнение соответствующие значения, получаем


Рис. 14-14. Активный транспорт растворенного вещества против градиента концентрации. Начиная с момента равновесия, т.е. с того момента. когда концентрации данного растворенного вещества в обоих компартментах одинаковы, активный транспорт вещества из одного компартмента в другой обеспечивает его перемещение против градиента концентрации. Для создания и поддержания градиента концентрации какого-либо растворенною вещества между компартментами, находящимися по обе стороны мембраны, требуется затрата свободной энергии. Если энергия почему-либо перестает поступать, то вещество из компартмента с более высокой его концентрацией начинает диффундировать обратно, и диффузия продолжается до тех пор. пока снова не установится равновесие, т. е. пока концентрации вещества по обе стороны мембраны не сравняются.
Изменение свободной энергии выражается в этом случае положительной величиной, и это значит, что 2,72 ккал свободной энергии, которые требуются для переноса 1 моля глюкозы (или любого нейтрального вещества) против стократного градиента концентрации, должны быть переданы системе за счет какой-то сопряженной реакции, способной служить источником энергии.
Градиенты концентрации между двумя сторонами клеточных мембран (трансмембранные градиенты) варьируют очень сильно. Пожалуй, максимальный градиент концентрации в организме поддерживается плазматической мембраной обкладочных клеток слизистой оболочки желудка, секретирующих соляную кислоту в желудочный сок. Концентрация в желудочном соке может достигать тогда как концентрация ионов в клетках составляет приблизительно . Это означает, что обкладочные клетки обладают способностью секретировать ионы водорода даже против градиента порядка . По-видимому, эти клетки имеют какие-то очень активные мембранные «насосы» для секреции ионов водорода, так как для поддержания столь высокого градиента концентрации требуется значительное количество энергии. Перенос веществ через мембраны против градиента концентрации называют активным транспортом. Образование желудочной стимулируется особым, связанным с мембраной ферментом - так называемой -транспортирующей АТРазой. При образовании желудочного сока на каждую молекулу цитозольного АТР, гидролизованного до ADP и фосфата, из цитозоля наружу через плазматическую мембрану выводятся два иона .
Другим важным примером активного транспорта может служить перенос ионов через плазматическую мембрану во всех животных клетках. Лучше всего изучен этот процесс в эритроцитах. Установлено, что концентрация в цитозоле эритроцитов достигает примерно тогда как в плазме крови она составляет всего . В то же время концентрация в плазме крови достигает а в эритроцитах она равна приблизительно . Для поддержания столь высоких трансмембранных градиентов требуется энергия АТР. В мембране эритроцита содержится специализированный фермент, получивший название -транспортирующей АТРазы, который функционирует и как фермент, и как молекулярный насос. Эта АТРаза катализирует гидролитическое расщепление АТР до ADP и фосфата, а высвобождающуюся при этом свободную энергию использует для перекачивания ионов из окружающей среды внутрь клетки, а ионов из клетки в окружающую среду (рис. 14-15). Стадией, на которой происходит передача энергии в этом процессе, является перенос концевой фосфатной группы АТР на молекулу -АТРазы.

Рис. 14-15. Схема, поясняющая действие -АТРазы. Для транспорта в клетку (где его концентрация выше, чем в окружающей среде) и транспорта из клетки в окружающую среду (где концеш рация этих ионов выше, чем в клетке) требуется свободная энергия. Источником ее служит гидролиз АТР. На каждую молекулу АТР, гидролизованного до ADP и из клетки выходят три иона и два иона поступают в нее из окружающей среды. Этот транспорт ионов включает два этапа. На первом этапе молекула АТРазы фосфорилируется под действием АТР. и это позволяет ей присоединить ион На втором этапе присоединяется ион следствием чего оказывается перенос и К через мембрану с отщеплением свободного фосфата, поступающего в цитозоль. АТР и продукты его гидролиза (ADP и ) остаются в клетке.